Entenda a teoria mais aceita no mundo sobre a relação entre a genética e o Transtorno do Espectro do Autismo utilizando o ‘modelo de copo’
Apesar dos estudos científicos evidenciarem que no autismo o risco genético é estimado em mais de 97% (conforme estudo de 2019) [9], com herdabilidade de 81%, o diagnóstico do Transtorno do Espectro do Autismo (TEA) é baseado em exame clínico, realizado por neuropediatras ou psiquiatras, seguindo as considerações da 5ª edição do Manual Diagnóstico e Estatístico de Transtornos Mentais (DSM-5). Além dos fatores genéticos, fatores ambientais corroboram como esse transtorno embora ainda muitos estudos sejam inconsistentes (conforme estudo de 2017) [3]. A idade paterna e o uso de ácido valpróico são dois fatores de risco importantes e comprovados. Já idade materna, exposição materna a toxinas e poluentes, desnutrição e alimentação na infância, baixo peso no nascimento ainda precisam ser melhor estudados embora já sejam considerados como fatores de risco e o uso de vitaminas, vacinação, dentre outros, não tem impacto significativo para o risco do TEA (conforme estudo de 2017) [3].
Os avanços tecnológicos foram importantíssimos para a evolução do conhecimento e a identificação de genes relacionados à etiologia do TEA. De acordo com informações obtidas em agosto de 2019, no site da Simons Foundation (SFARI genes), 1.089 genes foram relacionados com autismo. Com essa evolução constante no conhecimento dos genes associados ao TEA, estudos científicos sugerem que a realização de painéis para autismo não são os melhores instrumentos para o conhecimento genético desses indivíduos pela limitação do conhecimento (segundo estudos de 2016 e 2017) [4,5], e também não permitirá que genes associados a outras condições de saúde sejam avaliados, apenas testes genéticos como exoma ou genoma permitem esse tipo de análise (conforme estudo de 2017) [4].
O teste de array genômico — microarray genômico (SNP-array) ou Hibridização Genômica Comparativa (CGH-array) — está substituindo o cariótipo e vem sendo recomendado pelas Academia Americana de Genética Médica e Genômica (do inglês, ACMG), Academia Americana de Pediatria (do inglês, ACPeds) e de Psiquiatria Infantil e da Adolescência (do inglês, AACAP) em crianças com deficiência global do desenvolvimento e TEA (de acordo com estudos de 2011 e 2017) [6]. A ausência de alterações nesse exame não significa afirmar que não existem alterações genéticas, pois esse exame detecta apenas microdeleções e microduplicações cromossômicas.
Uma única alteração genética é suficiente para causar o TEA, mas na maioria dos casos não ocorrem apenas devido a alterações em um único gene, pelo contrário, elas envolvem distúrbios moleculares complexos em múltiplos genes importantes para os processos biológicos, como também em genes que controlam, durante o neurodesenvolvimento, a expressão gênica. Além disso, muitas variantes genéticas associadas ao TEA estão relacionadas a outras condições do neurodesenvolvimento como Deficiência Intelectual (DI), Transtorno Obsessivo Compulsivo (TOC), Transtorno de Déficit da Atenção com Hiperatividade (TDAH) e algumas condições psiquiátricas como esquizofrenia, depressão e transtorno do humor e afeto. Por todas estas razões, ainda é um grande desafio definir genes e respectivas variantes genéticas de relevância clínica associadas ao TEA (estudo de 2018) [7].
O TEA é um excelente modelo para demonstrar a complexidade genética do neurodesenvolvimento, pois apresenta um espectro clínico amplo, com fatores genéticos variados e complexos podendo ser herdados ou não. As formas não sindrômicas têm uma herança multifatorial associada a riscos ambientais e genéticos em uma combinação de característica aditiva (de acordo com estudo de 2018) [7]. A herdabilidade nos primeiros estudos genéticos, realizados na Suécia em 2014 e 2017, foi de 50% e 83%, respectivamente, e no último estudo, de 2019, com mais e 2 milhões de indivíduos, de 5 países diferentes, chegou a 81% enquanto que o risco genético está acima de 97%. Convém ressaltar que toda doença hereditária é genética, mas nem toda doença genética é hereditária.
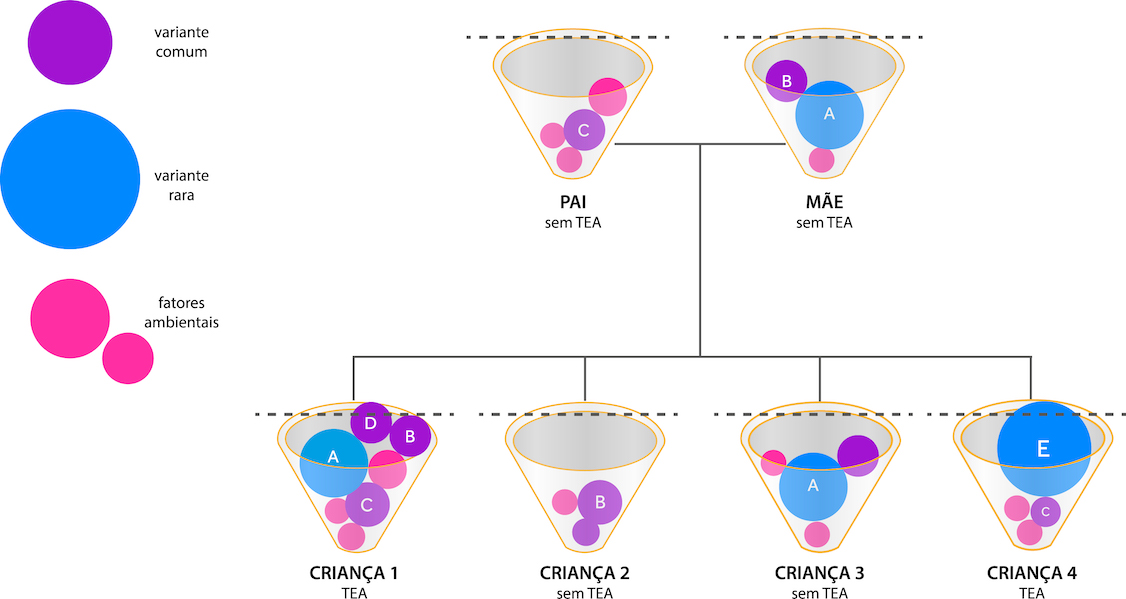

O modelo genético que explica o TEA foi chamado de “modelo de copo” e é um modelo de herança e limiar multifatorial que apresenta os impactos das variantes genéticas e ambientais com maior ou menor risco associado ao TEA, representados por círculos de tamanhos diferentes (estudo de 2018) [7] e a borda do copo representa o limite. Observe que indivíduos que ultrapassam esse limite estão no TEA (Figura 1).


No “modelo de copo”, os indivíduos do sexo masculino são representados por copos de tamanho menor, em relação ao sexo feminino, demonstrando uma diferença para atingir o limiar de diagnóstico (Figura 2). Estudos científicos mostraram que mulheres com TEA tem um número muito maior de variantes genéticas associadas ao transtorno se comparadas a homens com TEA, sugerindo que indivíduos do sexo feminino são mais resistentes a tais mutações o que explicaria a proporção de 4 meninos para 1 menina de acordo com o CDC (conforme estudo de 2014) [8].
Devemos ter em mente que o TEA é uma condição multigênica e multifatorial com combinação de variantes genéticas raras e comuns, que podem ou não ser herdadas. A realização do exame genético permite o conhecimento das variantes genéticas do paciente, mas pode trazer conhecimento acerca de comorbidades associadas, bem como outras condições de saúde. Além disso, pode ser importante no tratamento de comorbidades, nas intervenções comportamentais, na estratificação de pacientes, o que já acontece na Europa e na América do Norte, proporcionando testes clínicos mais personalizados [7]. A análise genética dos pais também poderá ser realizada permitindo verificar a hereditariedade das alterações genéticas encontradas e poderá auxiliar na avaliação de risco de recorrência de outros casos de TEA na família e, portanto, no aconselhamento genético como também na relevância clínica das variantes. Mutações do tipo “de novo” e raridade são fatores importantes nesta análise e no prognóstico do autismo.
Convém ressaltar que as pesquisas acerca da genética vêm para ajudar as pessoas com autismo e jamais devem ser usadas para eugenia. O conhecimento genético é importante para entender as causas do autismo e trazer uma identidade a esses indivíduos. Ainda, o diagnóstico precoce e tratamento personalizado são importantes para a melhora da qualidade de vida dos pacientes e a sua evolução, mas não significa a cura do paciente. Ele visa diminuir os sintomas indesejáveis como a epilepsia, dificuldades de aprendizagem ou distúrbios gastrointestinais.
Por fim, vale ressaltar que o conhecimento genético dos indivíduos com TEA está alterando gradualmente o conceito científico e clínico e pode ser mais útil que apenas ser utilizado para diferenciar TEA sindrômicos e não-sindrômicos.
[Texto atualizado em ago/2019, da versão original publicada na Revista Autismo número 4, de março/2019]
Referências
[1] “Most genetic risk for autism resides with common variation” Gaugler, T., Klei, L., Sanders, S.J., Bodea, C.A., Goldberg, A.P., Lee, A.B., Ripke, S. Nature Genetics. 46(8), 881-885, 2014.
[2] “The Heritability of Autism Spectrum Disorder” Sandin S., Lichtenstein P., Kuja-Halkola R., Hultman C., Larsson H., Reichenberg A. JAMA 318(12):1182-1184, 2017.
[3] “Environmental factors associated with autism spectrum disorder: a scoping review for the years 2003–2013” Ng M., de Montigny J.G., Ofner M., Do M.T. Health Promotion and Chronic Disease Prevention in Canada 37(1): 1–23, 2017.
[4]. Comorbid analysis of genes associated with autism spectrum disorders reveals differential evolutionary constraints.David MM, Enard D, Ozturk A, Daniels J, Jung JY, Diaz-Beltran L, Wall DP. PloS one, 11(7), e0157937, 2016.
[5] “Autism genetics: opportunities and challenges for clinical translation”. Vorstman, JAS. Parr JR., Moreno-De-Luca D., Anney RJL., Murnberger JI., Hallmayer JF. Nature Reviews Genetic 18(6), 362, 2017.
[6] “Microarray as a first genetic test in global developmental delay: a cost-effectiveness analysis”. Trakadis Y., Shevell M. Dev. Med. Child Neurol 53:994-999, 2011.
[7] “Communicating complex genomic information: A counselling approach derived from research experience with Autism Spectrum Disorder.” Hoang, N., Cytrynbaum, C., Scherer, S. W.Patient education and counseling. 101(2): 352-361, 2018.
[8] “A higher mutational burden in females supports a “female protective model” in neurodevelopmental disorders” Jacquemont S., Coe B.P., Hersch M., Duyzend M.H., Krumm N., Bergmann S., Beckmann J.S., Rosenfeld J.A., Eichler E.E. American Journal of Human Genetics 94(3):415-25, 2014.
[9] Bai, D., Yip, B. H. K., Windham, G. C., Sourander, A., Francis, R., Yoffe, R., Gissler, M et al. Association of genetic and environmental factors with autism in a 5-country cohort. JAMA psychiatry, 2019. doi: 10.1001/jamapsychiatry.2019.1411.